危険物取扱者(きけんぶつとりあつかいしゃ、Hazardous Materials Engineer)は、危険物を取り扱ったり、その取扱いに立ち会うために必要となる日本の国家資格です。 このページはりすさんが作成した試験問題アプリ、りすさんシリーズの紹介と試験に出題された項目をまとめたページです。
アプリで学習するなら
 ▶androidはこちら
▶androidはこちら
 ▶iphoneはこちら
▶iphoneはこちら
LINK
基礎的な物理学及び基礎的な化学
物質の三態、熱、電気など
気体、液体、固体の状態を三態といいます。
それぞれが変化するときの用語を理解しましょう。
それぞれに必要な熱量は語尾に”熱”をつければいいだけ
例:昇華→昇華熱、蒸発→蒸発熱
沸点とは
沸騰するときの温度です。
液体の飽和蒸気圧 = 液体にかかる外圧(大気圧)の時の液温
外圧が大 → 沸点は高くなる
外圧が小 → 沸点は低くなる
比熱とは
物質1gの温度を1℃上昇させるのに必要な熱量
比熱 = 熱量 / (質量 × 温度差)
熱量 = 比熱 × 質量 × 温度差
熱の移動
熱の移動は、伝導(熱伝導)、放射、対流の三種類があります
熱伝導率は数値が大きいほど熱が伝わりやすい
熱伝導率の大きさ 固体 > 液体 > 気体
熱膨張によって増加する体積 = 元の体積 × 体膨張率 × 温度差
体膨張率の大きさの順 気体 > 液体 > 固体
静電気
導電性が高い → 静電気が発生しにくい
導電性が低い → 静電気が発生しやすい
静電気の防止方法
①電気を通しやすい材質を使う
②湿度を高くする
③液体の流速を遅くする
④接地(アース)を施す
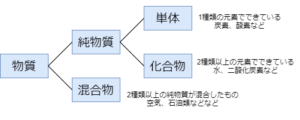
物質の種類
モルってなんだ?
別名、物質量といい、molとも書きます。単位の一つです。
正しい定義はありますが、それを理解するより原子量、分子量にグラムをつけた量が1モルと覚えたほうがいいかもしれません。
例:
酸素は分子量が32なので、32グラムで1モル
水は分子量が18なので、18グラムで1モル
例題:炭素を24g燃やすことで発生する二酸化炭素は何gか?
①反応式を書く
C + O2 → CO2
②それぞれの原子量、分子量から
炭素は原子量12なので12gで1モル
酸素は原子量16で酸素分子はその倍だから32gで1モルになる
③反応式を見ると、炭素1個と酸素1個が反応して二酸化炭素が1個できているので、単純に炭素1モルと酸素1モルで二酸化炭素1モルができると考える。
つまり、炭素12gと酸素32gで二酸化炭素44gができる。
問題では炭素24gと言っているので、2倍すればよい
答え 88g
酸と塩基、酸化と還元など
酸とは水素イオンを出すもの
例:塩酸、酢酸(酢)、炭酸水etc
塩基(アルカリ性)は水酸化物イオンを出すもの
例:漂白剤、石鹸etc
ポイント
酸は青色リトマス紙を赤色に変える(青→赤)
塩基は赤色リトマス紙を青に変える(赤→青)
pH(ピーエッチ又はペーハー)について
酸・アルカリの度合い(強さ)を表すのに、pHと呼ばれる数値を使います。
pH0 pH7 pH14
酸性 ← 中性 → アルカリ性(塩基性)
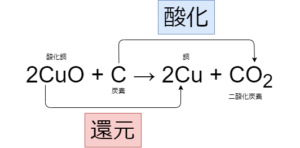
酸化と還元とは
表のような定義になります
| 酸化 | 還元 |
| 酸素と結びつく | 酸素を失う |
| 水素を失う | 水素と結びつく |
例:
酸化銅は酸素を失って銅になっているので還元されています
炭素は酸素とくっついて二酸化炭素になっているので酸化しています
| 酸化剤(相手を酸化する) | 還元剤(相手を還元する) |
| 相手に酸素を与える | 相手から酸素を奪う |
| 相手から水素を奪う | 相手に水素を与える |
| 自分は還元される | 自分は酸化される |
イオン化傾向
大←イオン化傾向(陽イオンになりやすさ)→小
カリウム > 鉄 > 銅 > 銀 > 金
| 金属の腐食が進みやすい環境 |
| 1.水分や過剰な塩分が存在する場所2.異なった土質にまたがる場所3.酸性が高い土中などの場所4.中性化の進んだコンクリート内5.迷走電流が流れている場所6.異種金属が接続している場所 |
同素体、化学変化など
同じ元素の単体で異なる物質を互いに同素体という。同じ元素であるが、性質は異なる。
例:
化学変化、物理変化
化学変化とは、別の物質に変わる変化
例:水が水素と酸素になる
物理変化とは、物質の形や状態が変わる変化
例:水が氷になる、水蒸気になる
計算問題の解き方
問題:
200gの水に10gの食塩を溶かした場合、溶液の濃度は何%か?
まず、水200gに食塩10gを溶かした場合、総量は210gになる
問題文は食塩水210gに食塩がどれくらい入っているか?ということを聞いているので、食塩10gを食塩水210gで割って100倍すればいいことになります。
食塩10g ÷ 食塩水210g = 0.0476・・・
これを100倍してあげれば濃度が求めらます
0.0476×100 = 4.76%
問題:
ある物質100gを5℃から35℃まで上昇させるために、7560Jの熱量を使用した。この物質の比熱はいくらか?
比熱は 熱量/(質量×温度差)で計算するので、
7560 /(100×30)= 2.52 となる
問題:
75℃の銅500gを10℃の水に入れたところ、全体の温度が15℃になった。銅の比熱を0.40J/(g・K)とすると、銅から出ていった熱量はいくらか。ただし、熱の移動は銅と水の間でのみ行われていたものとする。
熱量は比熱×質量×温度差なので
0.4×500×60
=12000
=1.2×104
問題:
10度の水200gに、4,200Jの熱量を与えると、水の温度は何℃になるか。ただし、水の比熱は4.2J/(g.K)とする。
まずは問題分の説明からします。4,200J→4,200ジュールと読み、熱量の単位になります。そして「水の比熱は4.2J/(g.K)とする」と書いてありますが、1gの水を1℃上げるのに必要な熱量は4.2Jになりますと教えてくれています。
まず、水200gを1℃上げるのに必要な熱量を計算します。
4.2J×200g = 840J
水200gを1℃あげるには840J必要で、4,200Jを加えられたということは
4,200J÷840J = 5℃
4,200J加えられると、5℃温度が上がることがわかったので、10℃の水200gは
10℃+5℃ = 15℃になります。
問題:
容積1000Lのタンク内を満たしているガソリンの液温を16℃から36℃まで上昇させた場合、タンク外に流出するガソリンの量はいくらか。ただし、ガソリンの対膨張率は1.35×10-3K-1とし、、タンクの膨張及びガソリンの蒸発は考えないものとする
熱膨張によって増加する体積は
元の体積×体膨張率×温度差であるので、
1000×1.35×10-3×20
=27.0
問題:
ある液体の危険物の蒸気を、空気100Lと混合させ、この均一な混合気体に電気火花を発した場合、燃焼可能となる蒸気の体積は次のうちどれか。ただし、この液体危険物の燃焼範囲は、以下のとおりとする。
上限値 6.0vol%
下限値 1.1vol%
(1)1L (2) 2L (3) 10L (4)15L (5)20L
混合気体中の可燃性蒸気の濃度が、燃焼範囲内にあれば燃焼可能となる。可燃性蒸気の濃度は次の式となる
可燃性蒸気の濃度 = 可燃性蒸気の体積 / 混合気体の体積 × 100
この式に選択肢の体積を当てはめて計算すると
1 / 101×100=0.990
2 / 102×100=1.960
10 / 110×100=9.090
15 / 115×100=13.04
20 / 120×100=16.66
燃焼範囲に当てはまるのは(2)の2Lになる
問題:
1,000Lのガソリンの温度を40℃上げた時に、何リットルになるか。ただし、体膨張率は1.35×10-3K-1とする
体膨張率とは、温度を1℃上げた時の、体積の増加量のことです。
計算方法はガソリン1,000Lに体膨張率と温度をかければいいことになります。
0.00135×40℃×1000L = 54L
※1.35×10-3は0.00135
計算から54L増えるとわかったので答えは
1,000L+54L=1,054L
燃焼と炎色反応、消火
金属の中には、バーナーの炎で燃やすと特有の色が生じるものがあります。
主には花火などに使われる。
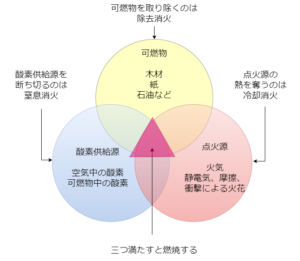
燃焼の3要素
燃焼は可燃物、酸素供給源、点火源の3つが同時に存在しないといけません(燃焼の3要素)
したがって、消火のためにはこのうちの1つを取り除けばよいことになります
| 消火剤ごとの主な消火方法 | |||||
| 消火剤 | 効果 | 状態 | 普通火災 | 油火災 | 電気火災 |
| 水 | 冷却 | 棒状 | 〇 | × | × |
| 霧状 | 〇 | × | 〇 | ||
| 強化液 | 冷却 | 棒状 | 〇 | × | × |
| 冷却、抑制 | 霧状 | 〇 | 〇 | 〇 | |
| 泡消火剤 | 窒息、冷却 | ー | 〇 | 〇 | × |
| 二酸化炭素 | 窒息、冷却 | ー | × | 〇 | 〇 |
| ハロゲン化物 | 窒息、抑制 | ー | × | 〇 | 〇 |
| 粉末消火剤 | 窒息、抑制 | リン酸塩類 | 〇 | 〇 | 〇 |
| 炭酸水素塩類 | × | 〇 | 〇 | ||
注意点
二酸化炭素は酸素と十分に化合しているため不燃物
一酸化炭素は酸素と十分に化合していないため可燃物
| 燃焼の仕方 | ||
| 蒸発燃焼 | ジエチルエーテルガソリン灯油軽油など | 液体 |
| 硫黄ナフタリンなど | 固体 | |
| 分解燃焼 | 木材石炭プラスチックなど | |
| 自己燃焼 | ニトロセルロースセルロイドなど | |
| 表面燃焼 | 木炭コークスなど | |
| 燃焼の難易 |
| 1.可燃性蒸気が発生しやすい2.発熱量(燃焼熱)が大きい3.熱伝導率が小さい4.乾燥度が高い(含水成分が少ない)5.周囲の温度が高い6.酸化されやすい7.表面積が大きい |
| 燃焼しやすくするには→粉状にする or 噴霧状にする |
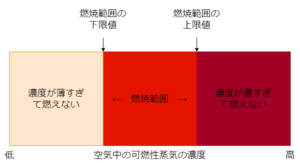
燃焼範囲
可燃性蒸気の濃度
=蒸気の体積/(蒸気の体積+空気の体積)×100
| 主な蒸気の燃焼範囲 | ||
| 蒸気 | 燃焼範囲(爆発範囲) | |
| 下限値(下限界)vol% | 上限値(上限界)vol% | |
| ガソリン | 1.4 | 7.6 |
| 灯油 | 1.1 | 6.0 |
| 軽油 | 1.0 | 6.0 |
| エタノール | 3.3 | 19 |
| ジエチルエーテル | 1.9 | 36 |
| 自然発火の原因となる主な発熱 | |
| 酸化熱 | 乾性油、原綿、石炭、ゴム粉 |
| 分解熱 | セルロイド、ニトロセルロース |
| 吸着熱 | 活性炭、木炭粉末 |
| 微生物による熱 | たい肥、ごみ |
引火点と発火点
| 引火点 | 発火点 |
| 燃焼範囲の下限値を示す時の液温 | 自ら発火するときの最低温度 |
| 点火源は必要 | 点火源は不要 |
| 可燃性の液体(まれに固体) | 可燃性の固体、液体、気体 |
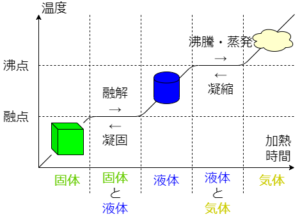
物質の状態変化と熱の出入り
固体→液体は融解
固体→気体は昇華
液体→気体は気化 いずれも熱を吸収する
気体→液体は凝縮
気体→固体は昇華
液体→固体は凝固 こちらは熱を放出する
固体、液体、気体間の状態変化時は温度は変化しない
10℃の時、5,000Lのガソリンが、30℃になると約何L増えるか。
元の体積×体膨張率×温度差というふうに計算する
5,000×0.00135×(30-10)n=135L
化学
混合物とは、2種以上の単体や化合物が混ざってできているものをいう
化合物とは、2種類以上の元素からなる物質をいう
沸点とは、液体の飽和蒸気圧と外圧(通常1気圧)が等しくなるときの液温をいう
水素と酸素が結合して水になる化学変化は化合である
水が酸素と水素に分かれる化学変化は分解である
亜鉛に希硫酸を加えると水素と硫酸亜鉛になる化学変化は置換である
一般に化学反応には熱の発生か吸収を伴う
比重が同じであれば、同一体積の物体の質量は同じである
赤リンと黄リンは同素体だが化学的性質は異なる
燃焼に関する説明
液体の可燃物の液面から蒸発した可燃性蒸気が空気と混合し燃焼することを蒸発燃焼という
固体の可燃物が加熱により分解し、その生成ガスがまず燃焼することを分解燃焼という
ニトロセルロースのように、分子内に多量の酸素を含有し、その酸素が燃焼に使われることを自己燃焼という
気体の燃焼には、定常燃焼と非定常燃焼の2つがある
固体自身が燃焼することを表面燃焼という。例:木炭、コークス
燃焼とは、酸化反応のうち、熱と(場合によって)光を伴うものをいう
燃焼の3要素は、可燃性物質、酸素、火源(熱源)である
酸素濃度によって燃焼速度は異なる
不完全燃焼の状態に酸素を供給すると、一気に燃え上がる現象がある
燃焼に必要なのは酸素であって、空気とは限らない
酸化されやすい物質は燃焼しやすい
熱伝導率の小さい物質は燃焼しやすい
燃焼は、熱と光の発生を伴う酸化反応である
可燃性液体は、液体そのものではなく、蒸発した蒸気が燃焼する。
火災と適応する消火剤
ハロゲン化物はガスで消すので、感電するかもしれない電気火災、水をかけれない油火災に適している
アルコフォームは耐アルコール性能を有しており水溶性液体の消火に適している
泡消火は水を含んでいるので、電気火災で使用すると感電の危険がある。油火災に適応している
強化液消火剤には、アルカリ金属塩の水溶液が使われている
粉末消火器は、油火災に適応している
二酸化炭素消火剤は、人体への影響があるので密閉された空間での使用は危険である
物質の比重
金:19.3
銀:7.86
水:1.00
ベンゼン:0.88
アルコール:0.80
熱の移動
熱せられた物体が熱を出して他の物体に熱を与える現象をふく射という
液体自身の移動によって熱が移動する現象を対流という
物質が移動せずに熱が移動する現象を伝導という
金属は非金属より熱伝導率が大きい
固体は、一般に液体より熱伝導率が大きい
静電気
静電気が放電して発生する火花で、可燃性蒸気に点火することがある
配管を流れる液体の速度を上げれば、静電気の帯電量は多くなる
絶縁性を高めても静電気の蓄積を防止できない
静電気が蓄積しても熱は発生しない
物質の接触でも静電気は起きる
有機化合物
有機化合物は、一般に水に溶けにくいものが多い
有機化合物は、一般に有機溶剤に溶けやすいものが多い
有機化合物は一般に可燃性であり、燃焼させると主に二酸化炭素と水を生じる
有機化合物の構成元素は、炭素、水素、酸素が主体である
有機化合物は、一般に融点や沸点が低いものが多い
200gの水に10gの食塩を溶かした場合、溶液の濃度は何%か。
水200gに塩10gを入れるので全体では210gになる
よって、塩10gを塩水210gで割ってあげればよい
10g÷(200g+10g)≒0.476
引火点と発火点
引火点は液体のみに用いられ、気体や固体では用いられることはない
引火点は、可燃性液体の蒸気濃度が燃焼範囲の下限値に達したときの液温をいう
発火点とは、可燃物が自ら発火して燃焼を開始する最低の温度をいう
一般に引火点は発火点よりも低いことが多い
水による消火について
水による消火が有効なのは、
①水の持つ蒸発熱の大きさによる冷却効果
②発生する水蒸気による窒息効果
③発生する水蒸気が可燃性ガスを希釈
があるからである
比重について
酸素は空気より重い
ガソリンは水より軽いので水に浮く
エチルアルコールは水より軽いが、水に溶けるため浮かない
水の比重は4℃の場合に最大となる
二酸化炭素は空気より重い
熱膨張について
液体の体積は、温度変化に比例して増減する
固体の体膨張率は線膨張率の約3倍である
気体の膨張率は、液体に比べて大きい
気体の体積は、圧力が一定の場合、温度変化に比例して増減する
気体の体積は、温度が一定の場合、圧力に反比例して増減する
炭素を24g燃やすことで発生する二酸化炭素は何gか
C+O2=CO2
炭素の原子量=12.0
酸素の原子量=16.0
炭素を12gとした場合、発生する二酸化炭素は、
12g+(16g×2)=44g
炭素が24gの場合は、その倍なので、
44g×2=88g
炎色反応
炎色反応は
銅:青緑色
ナトリウム:黄色
カリウム:淡紫色
リチウム:赤色
カルシウム:橙赤色
酸化と還元
酸化
①水素化合物が水素を失うこと
②物質が酸素と化合すること
③物質が電子を失うこと
還元
①水素を受け取ること
②物質が酸素を失うこと
③物質が電子を受け取ること
引火点について
引火点が低いほど引火しやすい
発火点と同じ意味ではない
引火点は物質によって異なる
引火点が0℃以下の物質がある
液体の温度が引火点以下なら燃焼に必要な濃度の蒸気は発生していない。
燃焼範囲について
燃焼範囲のことを爆発範囲という
燃焼範囲は、可燃性蒸気の全体に対する容量割合で表す
燃焼範囲には、上限値と下限値が必ず存在する
燃焼範囲が広くて下限値の低いものは引火の危険性が高い
可燃性液体は、液体そのものではなく、蒸発した蒸気が燃焼する
水の性質
水の分子量は18である
食塩水の沸点は100℃より高い
水の沸点は、圧力が上昇すると高くなる
水の気化熱は2256.3J(539cal)である
水は4℃で密度が最大となる
比熱
比熱とは、物質1gの温度を1ケルビン上げるための熱量のことをいう
比熱は物質に依存する
比熱が小さければ、温まりやすい
比熱とは、2つの物体の温度を比べたときの差ではない
液体1gを気体にするために必要な熱量のことを比熱とはいわない
静電気
接地は静電気の帯電防止策の1つである 液体の流動でも静電気は発生する
静電気は人体にも蓄積する 静電気が蓄積されただけでは、物体から火災は発生しない
静電気は湿度が低くなるほど蓄積しやすい
物質の変化
鉄板が熱によりとけるのは、物理変化である
鉄板を温めると膨張するのは、物理変化である
鉄板が折れ曲がるのは物理変化である
鉄板が塩酸にとけるのは化学変化である
鉄板がさびるのは、化学変化である
シャルルの法則
「気体体積は温度1℃上昇するごとに0℃のときの体積の1/273ずつ増加する」
ボイルの法則
「気体体積は圧力に反比例する」
ボイル・シャルルの法則
「気体体積は、圧力に反比例し、また温度1℃上昇するごとに0℃ときの体積の1/273ずつ増加する」
アボガドロの法則
「すべての種類の気体は、同一圧力、同一温度、同一体積のとき、同じ数の分子を含む」
定比例の法則
「化合物を構成する成分元素の質量の比は常に一定である」
酸と塩基
水酸化ナトリウムは塩基性物質である
酸と塩基は中和して水と塩をつくる
酸は青色リトマス試験紙を赤色に変える
塩基は水溶液中で水酸イオンを出す
水素イオン指数6の水溶液は酸性である
物質の危険性
酸化性物質と還元性物質が混合すると、発火や爆発することがある
可燃性固体の粉塵が空気中に浮遊しているときに火気を近づけると、爆発することがある
可燃性液体が霧状になっているときに火気を近づけると、爆発することがある
酸化カルシウムや過酸化ナトリウムは、水と反応すると激しく発熱する
酸化性塩類と強酸が混合すると、発火や爆発することがある。
酸化剤と還元剤
酸化剤も還元剤も、反応させる物質によって逆の作用をする
ほかの物質により還元される性質をもつものを酸化剤という
還元剤は他の物質に水素を与える
還元剤は反応させる物質より酸化されやすいものを用いる
酸化剤は他の物質から水素を奪う
発火点
発火点に達すれば、熱源(火源)がなくても発火する
発火点に達しても、酸素がなければ発火しない
一般的に、同じ物質なら発火点は引火点よりも高い
ガソリンの発火点は約300℃である
可燃性液体の液面から、引火できる濃度の蒸気を発生するのは引火点である
消火
空気中の酸素が一定濃度以下になり不足すると、燃焼は停止する
液体の蒸気に引火して燃焼しているときは、液体の温度を下げれば燃焼は停止する
酸素を含有する物質の燃焼には、窒息消火は有効ではない
除去消火とは、可燃物を除去する方法である
燃焼物を物体で覆うと窒息効果がある
塩酸に溶けるもの
鉄、マグネシウム、亜鉛、アルミニウムは塩酸に溶ける
塩酸に溶けないもの
銅
アプリで学習するなら
 ▶androidはこちら
▶androidはこちら
 ▶iphoneはこちら
▶iphoneはこちら